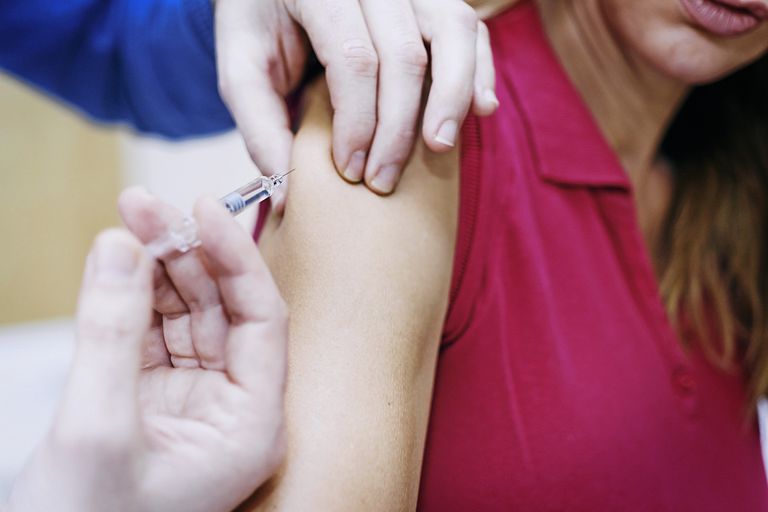
Heplisav-B je vakcína používaná na prevenciu všetkých podtypov hepatitídy B. Schválená americkým Úradom pre kontrolu potravín a liečiv (FDA) 9. novembra 2017 používať u dospelých vo veku 18 rokov a starších.
Je to jedna z troch vakcín, ktoré sa v súčasnosti používajú na prevenciu infekcie vírusom hepatitídy B (HBV) v Spojených štátoch. Patrí k nim spoločnosť Recombivax HB, ktorá bola schválená FDA v roku 1986 a vedúca spoločnosť na trhu Engerix-B, ktorej bolo udelené podobné schválenie v roku 2007.
(Existuje tiež tretia kombinačná vakcína známa ako Twinrix, ktorá vakcinuje proti hepatitíde A aj B.)
Jednou z hlavných prínosov lieku Heplisav-B je, že vyžaduje menej injekcií počas kratšieho časového obdobia, faktor, ktorý môže pomôcť ľuďom dokončiť sériu skôr ako zastaviť.
Počiatočné bezpečnostné obavy
Schválenie lieku Heplisav-B obmedzilo štvorročný boj o uvedenie vakcíny na trh. Úrad FDA predtým odmietol tento liek vo februári 2013 a neskôr v novembri 2016 z dôvodu obáv o bezpečnosť týkajúcich sa potenciálneho rizika akútneho infarktu myokardu (infarkt myokardu) a určitých autoimunitných ochorení.
Očkovacia látka bola nakoniec schválená na základe skutočnosti, že vyžaduje dva výstrely dodané jeden mesiac. Ostatné vakcíny naopak vyžadujú tri výstrely oddelené jedným mesiacom a potom šiestimi mesiacmi.
To bolo považované za dôležité, pretože jedna z najväčších prekážok vakcíny proti HBV bola adherencia.
V štúdii z roku 2008 oddelenia infekčných chorôb na University of Florida v Jacksonville bolo hlásených, že zo 707 osôb oprávnených na očkovanie proti HBV iba 503 malo prístup k liečbe a iba 356 dokončilo tri razie. Ďalšie štúdie zaznamenali podobne slabé výsledky.
Zúžením medzery medzi injekciami sa FDA domnieva, že prínosy vakcíny ďaleko prevažujú nad akýmkoľvek potenciálnym dôsledkom. Účinnosť
Schválenie lieku Heplisav-B bolo založené na údajoch z troch klinických štúdií zahŕňajúcich viac ako 14 000 dospelých účastníkov. Hlavná štúdia porovnávala priebeh dvoch dávok lieku Heplisav-B s trojdávkovou sériou lieku Engerix-B. Z celkového počtu 6 665 účastníkov štúdie dosiahlo 95% vysokú úroveň ochrany proti Heplisav-B (meranú aktivitou protilátok) v porovnaní s 81% na lieku Engerix-B. V druhej štúdii zahŕňajúcej 961 ľudí s diabetom 2. typu (považovaných za pacientov s vysokým rizikom hepatitídy B) bolo hlásené, že Heplisav-B poskytuje vysokú úroveň ochrany u 90% tých, ktorí dostali očkovaciu látku, v porovnaní s iba 65% Engerix-B. Okrem toho je známe, že Heplisav-B poskytuje ochranu proti všetkým štyrom hlavným sérotypom, desať genotypov (A až J) a 40 subgenotypov.
Podanie
Heplisav-B sa podáva intramuskulárnou injekciou do horného deltového svalu ramena. Vakcína nie je živá očkovacia látka (obsahujúca živý, oslabený vírus), ale obsahuje geneticky modifikovaný antigén – v podstate avatar pre vírus – ktorý nespôsobuje ochorenie, ale skôr stimuluje ochrannú imunitnú odpoveď.
Po podaní prvej 0,5 mililitrovej (ml) injekcie sa druhá dávka dostane za šesť mesiacov.
Ak z nejakého dôvodu nie ste schopní dokončiť sériu v tejto dobe, porozprávajte sa so svojím lekárom o dokončení série čo najskôr. Je nepravdepodobné, že by ste museli reštartovať sériu.
Nežiaduce reakcie
Zatiaľ čo niektorí ľudia môžu pociťovať reakciu na výstrel, väčšina prípadov je mierna a vyriešená v priebehu niekoľkých dní. Reakcie, ak nejaké existujú, majú tendenciu byť hlbšie po prvom výstrele a menej za druhým.
Najčastejšie príznaky (vyskytujúce sa u viac ako dvoch percent pacientov) zahŕňajú:
opuch v mieste vpichu – 2,3 percenta
začervenanie v mieste vpichu – 4,1 percenta
malátnosť – 9,2 percenta
- bolesť hlavy – 16,9 percenta
- únava – 17,4 percenta
- Bolesť v mieste vpichu – 38,5%KontraindikácieHeplisav-B sa nemá používať u osôb s anamnézou ťažkých alergických reakcií alebo u osôb, ktoré už predchádzajúcu reakciu na očkovanie proti hepatitíde B alebo ktorejkoľvek z jej zložiek vrátane kvasiniek. Opätovná expozícia môže viesť k potenciálne život ohrozujúcej alergickej reakcii na celé telo známej ako anafylaxia.
- Doteraz neboli vykonané žiadne štúdie o účinku lieku Heplisav-B počas gravidity alebo dojčenia. Avšak štúdia na zvieratách neukázala žiadne nežiaduce udalosti ani u gravidných laboratórnych potkanov, ani u ich potomkov po dávke 0,3 ml Heplisav-B.
- Kto sa má očkovať
- Hepatitída B je vírusové ochorenie pečene, ktoré sa môže stať chronickým a môže viesť k cirhóze, rakovine pečene a smrti.
Podľa správy pracovnej skupiny pre preventívne služby USA (USPSTF), kdekoľvek od 700.000 do 2.2. že milióny ľudí je infikovaných HBV v Spojených štátoch. Sadzby infekcií sú najvyššie u dospelých 30 až 49, pričom väčšina z nich sa infikuje buď nechráneným pohlavím alebo spoločným používaním ihly.
Neexistuje žiadny liek na hepatitídu B, ale účinné očkovanie môže zabrániť ochoreniu. Z tohto dôvodu Poradný výbor pre imunizačné postupy (ACIP) a v súčasnosti odporúča, aby všetky deti dostali svoju prvú dávku vakcíny proti HBV pri narodení a dokončili sériu od 6 do 18 mesiacov. Staršie deti a dospievajúci, ktorí neobdržali očkovaciu látku proti HBV, by mali byť tiež očkovaní.
Centra pre kontrolu a prevenciu chorôb ďalej odporúča, aby boli všetci dospelí s vysokým rizikom HBV očkovaní. Patria medzi ne:
Osoba, ktorá žije s alebo má sex s niekým, kto má hepatitídu B
Sexuálne aktívne osoby, ktoré nie sú v dlhodobom, vzájomne monogamnom vzťahu
Osoby hľadajúce testovanie alebo liečbu sexuálne prenosných infekcií
Muži, ktorí majú sex muži
Ľudia žijúci s HIV
- Ľudia, ktorí zdieľajú ihly, injekčné striekačky alebo iné prístroje na liečbu
- Zdravotnícki pracovníci a iní, ktorí sú vystavení riziku vystavenia krvi
- Ľudia s konečným štádiom ochorenia obličiek
- Ľudia s chronickým ochorením pečene
- Ľudia s diabetom pod vekom 60 začali čo najskôr po diagnostikovaní
- Medzinárodní cestujúci do regiónov s miernym až vysokým výskytom hepatitídy B
- Osoby, ktoré prisťahovali z krajín s miernym až vysokým výskytom hepatitídy B alebo deti narodené rodičom, ktorí prisťahovali z týchto krajín predtým ich narodenie
- Ktokoľvek, kto sa domnieva, že je ohrozený
- USPSTF v súčasnosti neodporúča očkovanie proti HBV pre rody l dospelého obyvateľstva, pretože sa nepreukázalo, že sa znižuje riziko ochorenia súvisiaceho s pečeňou alebo smrťou.
- Skúmanie bezpečnostných problémov ◊ Napriek tomu, že verejní zdravotnícki pracovníci sú vo veľkej miere pozitívni, obavy o bezpečnosť naďalej znepokojujú očkovanie vzhľadom na jej skoré odmietnutie zo strany FDA.
- FDA pôvodne odmietla očkovaciu látku v roku 2013 na základe jednej z jej zložiek, známej ako CpG 1018. Toto je zlúčenina používaná na posilnenie schopností očkovania imunitnými vakcínami a práve táto, ktorá umožňuje dvojkrídlové série.
- Podľa odpovede FDA sa predpokladalo, že CpG 1018 má potenciál spúšťať určité autoimunitné poruchy, vrátane ochorenia štítnej žľazy. Zatiaľ čo skoré štúdie nepreukázali žiadny štatistický rozdiel medzi Heplisav-B a Engerix-B, žiadosť bola zamietnutá jednoducho preto, lebo veľkosť štúdie v tom čase bola považovaná za príliš malú.
- V čase opätovného podania bolo očkovanie vystavených 14 238 ľuďom len s dvoma prípadmi Hashimotovej tyreoiditídy (forma ochorenia štítnej žľazy) a jeden prípad vitiligu.
Neskôr v roku 2016 bola očkovacia látka tiež odmietnutá, keď jedna štúdia preukázala väčší počet než počet očakávaných srdcových príhod vrátane infarktu. V tomto prípade FDA požiadal o doplňujúce informácie týkajúce sa akýchkoľvek nesúvisiacich faktorov, ktoré by mohli pomôcť lepšie vysvetliť výsledky.

